1900-1913
В 1896 году французский физик А.Беккерель, изучая способность люминесцирующих веществ излучать рентгеновские лучи, обнаружил новое загадочное излучение, создаваемое солями урана. Это сообщение заинтересовало ученых Кавендишской лаборатории, и Резерфорд занялся опытами по сравнению рентгеновских и «беккерелевых» (несколько позже их стали называть радиоактивными) лучей. В ходе этих исследований в 1899 году он обнаружил, что излучение урана не однородно, а содержит по крайней мере две составляющие. Резерфорд назвал их α- и β-лучами и показал, что α-лучи обладают гораздо большей ионизующей способностью, чем β-лучи.
Природа β-излучения была выяснена довольно быстро - уже в 1900 году
было показано, что в электрическом и магнитном полях эти лучи ведут себя также, как и пучки электронов. Природа α-частиц пока не была известна, но Резерфорд уже тогда предугадал важность α-частиц и затем многие годы посвятил их изучению.
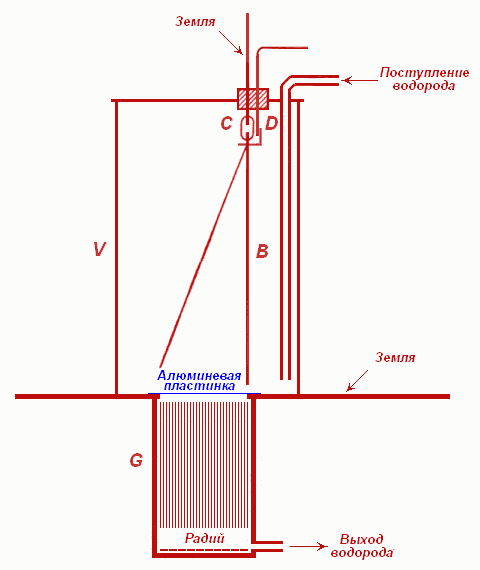
Рис. 1
Поставленные Резерфордом опыты свидетельствуют о его необычайном экспериментальном мастерстве и изобретательности. Для определения природы α-частиц в 1903 году он сконструировал прибор, схема которого приведена на рисунке 1. Электроскоп, сделанный из золотой фольги, помещался над двадцатью близко расположенными металлическими пластинками в эбонитовом ящике. Благодаря узким щелям между пластинками, α-частицы, испускаемые радиевой солью, проходили в камеру электроскопа параллельным пучком. Через прибор пропускался водород, который увлекал с собой накапливающийся в приборе радон и, тем самым, увеличивал длину свободного пробега α-частиц. Заряженные частицы ионизировали находившийся в электроскопе газ, и листочек электроскопа отклонялся от вертикального положения.
Для определения знака заряда α-частиц Резерфорд использовал эффект изменения направления движения заряженных частиц под действием магнитного поля. Щели между пластинками сверху прикрывались щитками, закрепленными с одной стороны. Прикладывая магнитное поле параллельно плоскостям пластинок, можно было так отклонять α-частицы, что они попадали либо на щитки, либо на стенки экрана. При этом ионизация воздуха в камере электроскопа прекращалась, и золотая фольга опускалась. Меняя направление магнитного поля, Резерфорд установил, в каком именно направлении отклоняются α-частицы, и отсюда заключил, что знак заряда этих частиц положительный. Затем Резерфорд подключил металлические пластинки к полюсам электрической батареи и по отклонению α-частиц в электрическом поле установил отношение их заряда к массе. Все указывало на то, что α-частицы являются, по-видимому, двукратно ионизованными атомами гелия.
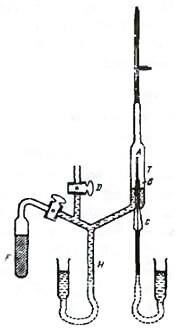
Рис. 2
Однако для полной идентификации α-частиц в 1909 году Резерфорд поставил еще один тонкий эксперимент. Изображенный на рисунке 2 прибор для опыта был изготовлен высококвалифицированным стеклодувом. Радиоактивный газ радон, испускавший α-частицы, помещался в тонкостенную стеклянную трубку, вставленную, в свою очередь, в более широкую трубку, из которой был тщательно откачан воздух. Через несколько дней во внешней трубке обнаруживался газ, который образовывался благодаря проникновению α-частиц через стенки внутренней трубки. Этот газ вытеснялся в малый отросток внешней трубки, через который пропускался электрический разряд. При этом наблюдались характерные желтые линии спектра излучения гелия. В результате этого опыта Резерфорд окончательно удостоверился, что α-частицы - это двукратно ионизованные атомы гелия.
В 1903 году Э.Резерфорд, совместно с английским физиком и химиком Ф.Содди, разработал теорию радиоактивного распада. Согласно этой теории, атомы тяжелых химических элементов могут самопроизвольно распадаться, и в этом процессе происходит превращение одних элементов в другие.
За проведенные им исследования распада радиоактивных элементов в 1908 году Резерфорд был удостоен Нобелевской премии по химии. По этому поводу он шутил, что имел дело со многими самыми различными превращениями, однако самым замечательным из них оказалось его собственное превращение в один миг из физика в химика.
Наиболее значительным вкладом Резерфорда в науку стало создание им планетарной модели атома. Еще проводя опыты по отклонению α-частиц магнитным полем, Резерфорд заметил, что если вакуум, в котором проводился эксперимент, был недостаточен, путь некоторых частиц слегка искривлялся. Для такого искривления требовалось сильное поперечное электрическое поле, и Резерфорд заключил, что атомы вещества должны быть средоточием больших электрических сил. Для проверки этой гипотезы Резерфорд поручил своему стажеру Э.Марсдену посчитать число α-частиц, проходящих от излучателя к экрану через различные пластинки. Этот опыт заключался в том, что через тонкую щель пучок α-частиц направлялся на экран из сернистого цинка, вспышки (сцинтилляции) на котором можно было наблюдать в микроскоп. При хорошем вакууме на экране наблюдалась лишь яркая полоска света, но когда на пути α-частиц оказывалась тонкая пластинка какого-нибудь вещества, α-частицы распределялись по большей площади экрана. В процессе этих измерений Марсден обнаружил крайне неожиданное явление: некоторые α-частицы отклонялись от предполагаемого направления гораздо сильнее, чем это допускалось существовавшими тогда представлениями о строении атома.
Согласно модели атома Томсона, положительные и отрицательные заряды равномерно распределены внутри атомной сферы. Анализируя же результаты своих экспериментов, Резерфорд понял, что силы, способные отклонить α-частицы на большой угол, могут возникать лишь в том случае, если положительный электрический заряд атома сконцентрирован в очень малом объеме и там же, в основном, сосредоточена его масса. Эту центральную часть атома Резерфорд, используя биологическую терминологию, назвал ядром. Вокруг ядра на большом отдалении от него по орбитам вращаются легкие электроны. Такая модель была подобна Солнцу с вращающимися вокруг него планетами, и поэтому Резерфорд назвал ее планетарной.
Допустив, что положительный заряд атома сконцентрирован в точке, Резерфорд показал, что частица, попадающая на близкое расстояние от него, описывает гиперболическую орбиту, причем угол отклонения частицы φ определяется равенством  , в котором р - прицельное расстояние, а буквой b обозначено выражение
, в котором р - прицельное расстояние, а буквой b обозначено выражение  , где Ne - центральный заряд, Е - заряд α-частицы, m и υ — ее масса и скорость соответственно. Величина b представляет собой наименьшее расстояние, до которого α-частица может проникнуть в глубь атома. По оценке Резерфорда, это расстояние порядка 3,4·10-12 см. Проведенная Г.Гейгером и Э.Марсденом проверка теории путем изучения рассеяния α-частиц на атомах многих элементов (от углерода до платины) показала полное согласие с выводами Резерфорда.
, где Ne - центральный заряд, Е - заряд α-частицы, m и υ — ее масса и скорость соответственно. Величина b представляет собой наименьшее расстояние, до которого α-частица может проникнуть в глубь атома. По оценке Резерфорда, это расстояние порядка 3,4·10-12 см. Проведенная Г.Гейгером и Э.Марсденом проверка теории путем изучения рассеяния α-частиц на атомах многих элементов (от углерода до платины) показала полное согласие с выводами Резерфорда.
Созданная Резерфордом теория и выведенная им формула выдержали испытание временем, подвергаясь в дальнейшем лишь проверкам и уточнениям. Из предложенной им модели атома стал ясен смысл периодического закона элементов, согласно которому они размещаются в таблице в соответствии с зарядом их ядер. В очень короткий срок, с 1911 по 1913 год, на основе опытов Резерфорда и теории квантов Планка были разработаны основы электронной оболочки атома и создана модель атома Бора. Так, опираясь на, казалось бы, простые опыты, формировалась обширная наука об атоме и атомном ядре, отцом которой по праву может быть назван Эрнест Резерфорд.
Источники:
1. Википедия – свободная инциклопелия
2. Академик